发布者:Primerbank 时间:2017-09-29 浏览量:8716
Rotor-Gene 6000
荧光定量PCR仪培训手册

基因有限公司生命科学组
目 录
一. Rotor Gene6000荧光定量PCR系统介绍………………………………………… 1
二. 系统安装与维护 ……………………………………………………………………… 4
三. 培训所需试剂、仪器及耗材………………………………………………………… 5
四. 培训程序及日程安排……………………………………………………………………6
五. 实验操作流程…………………………………………………………………………… 7
六. 软件使用培训…………………………………………………………………………… 9
七. 常见问题解答……………………………………………………………………………18
八. Rotor-Gene系统设置注意事项 ………………………………………………………21
九. 相对定量方法简介—Rotor-Gene上的实际操作…………………………………… 22
一、 Rotor Gene6000荧光定量PCR系统介绍
Corbett Research公司是著名的专业研制和生产生物仪器的厂家,产品主要包括Rotor-Gene离心式实时定量PCR 仪、CAS-1200 自动加样系统等。公司自成立以来一直致力于定量PCR 相关仪器的研究开发,将创新技术与精美工艺相结合,在仪器的性能、软件、外观上不断改进,推出临床、科研领域的佼佼者,真正的匀速离心式实时定量PCR 仪—— ROTOR-GENE 6000荧光定量PCR 系统。
1.系统技术参数
|
型号 |
6200 |
6200HRM |
6500 |
6500HRM |
6600 |
|
通道数 |
2 |
2+1 |
5 |
5+1 |
6 |
|
激发光源 |
2 |
2+1 |
5 |
5+1 |
6 |
|
检测滤光片 |
2 |
2+1 |
5 |
5+1 |
6 |
|
可检测荧光 |
FAM™, SYBR® Green I, Fluorescein, EvaGreen™, Alexa Fluor® 448; JOE™, VIC™, HEX™, TET™, Yakima Yellow®, CalGold™, Alexa Fluor® 532; LC Green®, LC Green® Plus+ (HRM) |
在6200础上增加ROX™, Cy3.5™, Redmond Red®, Alexa Fluor™ 568; Cy5™, Quasar670™, LCRed650®, Texas Red®, CAL Fluor™ Red 590; Quasar705™, LCRed705®, Alexa Fluor® 680; LC Green®, LC Green® Plus+ (HRM) |
在6500基础上增加Biosearch Blue™, Marina Blue®, Bothell Blue®, Alexa Fluor® 350 |
||
|
HRM |
N/A |
YES |
N/A |
YES |
N/A |
|
转速 |
400 rpm |
||||
|
控温范围 |
室温-99℃ |
||||
|
温度变化速率 |
10℃/秒 |
||||
|
温度均一性 |
±0.01℃ |
||||
|
温度分辨率 |
0.02℃ |
||||
|
样品量 |
0.2 ml×36,0.1ml×72,30ul×100 |
||||
|
尺寸 |
370mm宽,420mm深,560mm深(开门),275mm高 |
||||
|
电源 |
100-120VAC@60Hz, 200-240VAC@50Hz |
||||
Rotor-Gene是一套实时显示DNA扩增和杂交过程的循环变温系统。该装置能在其36孔转子上容纳36个0.2 ml的标准离心管。72孔转子配有0.1 ml四联管,并可选配72孔及100孔的GeneDisk™。
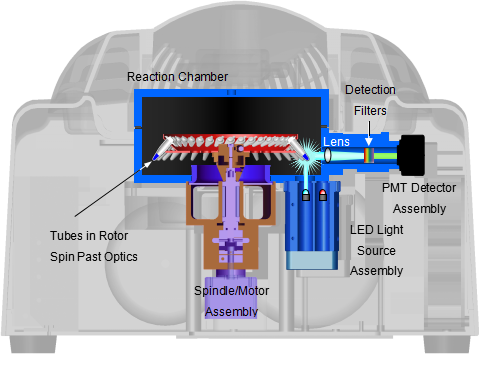
2.Rotor-Gene创新的系统结构
RG6000秉承了Rotor-Gene一贯的离心式的反应转子设计,反应中样品始终处于低速匀速转动中,保证各样孔相对位置的完全一致。从而排除因样孔相对位置差异和反应模块边缘效应引起的温度不均一性。
升温时,顶部金属加热器加热封闭的反应舱空气,降温时,底部强力排风扇迅速排出热空气,同时打开顶部气孔,达到快速空气交换。
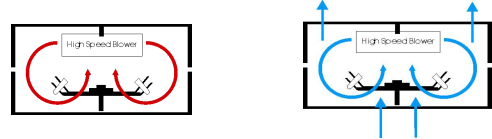
开放式转子设计,保证快速的热交换,相比其它定量PCR系统,运行速度更高。
优化的独立的LED激发光源,
保证最小的光谱交叉,离心式的模块保证每个样孔受到完全均一的激发。新的RG6000在RG3000的基础上又对光路进行了改进,使光路更加稳定,仪器的结构变得更紧凑。
适合所有定量PCR标记方法: 如Sybr Green, Taqman, MB, FRET, Quenched FRET, Ampliflour等。
开放的试剂系统:无需特定的酶和试剂,使用绝大部分厂家提供的酶和反应体系。
无需内参和特殊反应容器: 固定的光程和最小的光学交叉,无需内参校正系统;PCR管壁检测,普通PCR管即可满足要求。
RG6000有两款带有HRM功能的型号。无需序列特异型探针,仅用价格低廉的染料即可对片段进行基因型分析。
光学变性技术:有助延长酶活性,同时缩短反应时间。
自动温度校正:足不出户,便可对温度进行自动校正。
二、 系统安装与维护
1. 安装条件
1). 位置要求:稳定水平的操作平台放置设备,远离热源,避免阳光直射
2). 空间及载重要求:
3). RG6000主机:370mm宽,420mm深(560mm开门),275mm高
4). 重量:14Kg (此外,还需要有放置配套电脑的空间及载重)
5). 温度要求:15-35℃
6). 电源:90-250V AC
7). 其它:通用插头接线板
2. 维护
用户唯一需要做的维护措施是保持透镜清洁,避免灰尘积累。建议在不使用Rotor-Gene时,盖子要盖好以免灰尘落进加热腔中。反应舱下部和侧壁有仪器的光学组件,有灰时可以用吸耳球将灰尘吹出,或用沾有无水乙醇的棉签清洁。
三、 培训所需试剂、仪器及耗材
1. 试剂
1). HBV DNA试剂盒标准品
2). Sybr-Green I演示试剂盒
装机演示时选用其中一种实验试剂完成实验,具体使用哪种试剂根据当时公司备货情况。
2. 仪器及耗材
1). 台式离心机
2). 震荡混匀器
3). 移液器
4). 0.2 ml PCR反应管,1.5 ml EP管,Tip头(进口),乳胶手套等
以上物品请用户提前准备妥当,我公司培训人员将使用以上物品进行仪器使用的培训工作。如不具备请及时与培训技术人员联系。
四、 培训日程安排
请至少安排2名实验室长期工作人员参加培训,以后如有人员变动由客户自行负责。
1. Real-time PCR原理及应用讲座
2. RG6000仪器简介
3. 仪器安装及使用培训
4. 定量PCR演示试验
5. 软件基本功能综述及使用培训
五、 实验操作流程
实验目的:
验证机器的重复性、扩增线性及了解机器和软件的使用及其特点。
荧光定量PCR反应操作流程(以市售HBV病毒检测试剂盒为例):
1. 开机,根据试剂盒条件设置好PCR反应条件
2. 配置PCR反应混合液
3. 实验设计体系为:4个浓度梯度稀释的标准品,1-2组上述样品重复组,1个阴性对照
4. 除演示外,用户可自己操作完成一次实验
方法(二选一):
1. Taqman法
1). 在一个管中混合: (20μl体系)
HBV PCR Buffer(含探针及引物) N×15 μl
Taq酶 N×0.2 μl
(为了防止分液后最后一个管液体不足,N为实际PCR体系数加一。做四个标准品,一个阴性对照,其中一个标准品设置两组重复组,共7个样品,则N为8)
混合液混匀,离心(去除气泡),向每个PCR反应管中分装15μl。
2). 每管加等量DNA样品或阴性对照(ddH2O) 5ul *,混匀,离心,立即置于RG 6000荧光定量 PCR仪,进行PCR扩增反应。
* 其中四个管依次加经梯度稀释的标准品
(使用前混匀,离心),其中一个加ddH2O,作为阴性对照
3). 实验条件
Stage I:hold 95℃ 15 分
Stage II:cycle 94℃ 20 秒,58℃ 20秒,72℃ 20秒,采集,40个循环
2. Sybr-Green法
1). 反应体系:根据实际试剂盒情况进配制,样品同上
2). 实验条件
Stage I:hold 95℃ 15 分
Stage II:cycle 94℃ 20 秒,58℃ 20秒,72℃ 20秒,采集,40个循环
Stage III:melt 58-95℃
六、 软件使用培训
l 运行Rotor-Gene之前请阅读以下注意事项:
保证样品放满36孔或72孔,不足时用空管填满。
保证软件设置不在虚拟机状态。
尽量使用进口的0.2ml PCR管 (0.1ml为Corbett Research公司专配),放入转子后加上RG6000专配的压环。
用来做填充管的空管如果每次有压环压住可以不更换,但是如果无压环压牢,则需要在2-3次实验后更换新的PCR管,以免管盖弹开。
以下是关于配套软件Rotor Gene 6000 1.7版的简要操作说明。双击软件图标,进入软件操作。软件打开后会自动弹出“New Run”窗口,选择合适的程序后单击后,进入“New Run Wizard”操作,按提示要求对每个窗口进行设置,单击进入下一页面,完成反应设置。
设置一个反应的基本步骤:
1. 软件打开以后自动弹出 “New Run”窗口(见下图)。选择了合适的程序以后,按键。
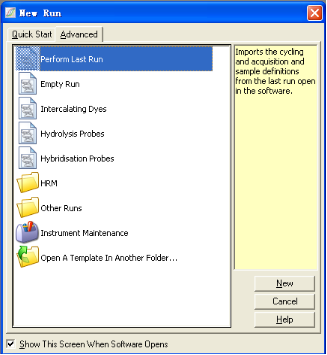
注意,RG6000对各个程序图标的说明与RG3000略有不同。原“Sybr-Green”现在以“Intercalating Dyes”表示,以代表内掺式染;Taqman法在“Hydrolysis Probes”表示,以代表所有此类探针;FRET探针以“Hybridisation Probes”表示,以代表所有此类探针。HRM方法归入“HRM”文件夹,其它方法归入“Other Runs”文件夹。以Sybr-Green法为例,选择“Intercalating Dyes”。
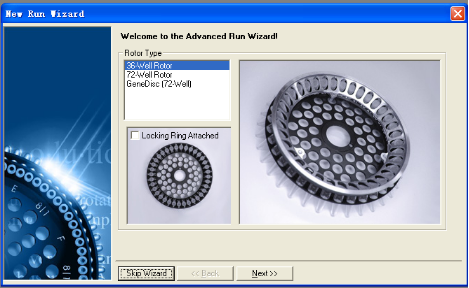
2. 选择所用的转子类型:36孔或72孔,并确Locking Ring压好了。然后单击进入下一步。
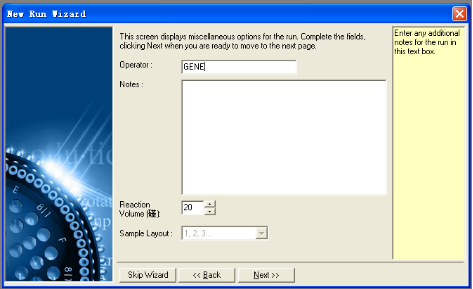
3. 填入操作者的姓名以及反应的备注信息(这两项可不填),并键入反应体积。按进入下一步骤。
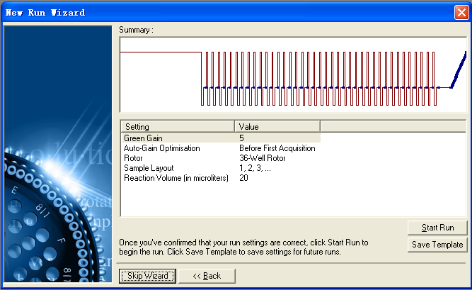
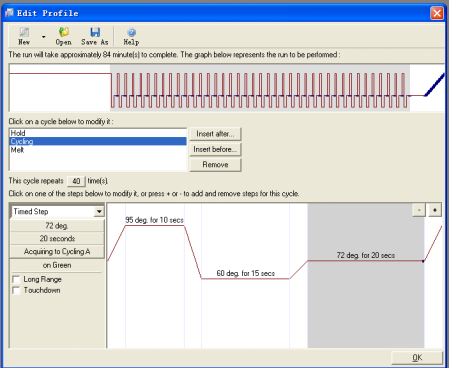
4. 选择“Edit Profile”进入程序设置。
4.1在“Edit Profile”窗口中,通过
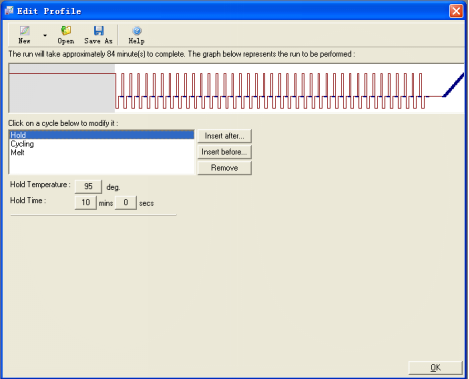
Insert before:允许在选定的项目之前插入一个步骤,比如在循环体之前加入一个保温过程
Insert after:允许在选定的项目之后插入一个步骤,比如加入一个熔解曲线
Remove:从列表中去除不要的步骤
Denature:设置变性温度和时间
Cycling:设置循环体
Melt:设置起止温度及每一个温度的持续时间
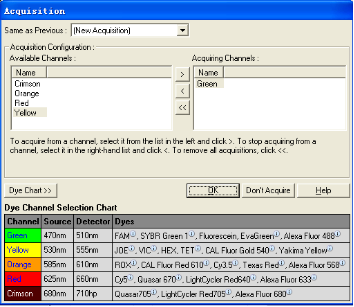
在设置“Cycling”内容时,窗口如下;该步除对反应时间,温度进行设置,还需要设定在哪步读取荧光,单击“Acquiring to Cycling A” 或“Not Acquiring”按钮会弹出“Acquisition”对话框,用[<],[>]和 [<<] 键在两个窗口中移动通道,所有列在右边的通道都是机器运行时要采集信号的通道。按 键确认结束对话。如果在这个循环步骤不采集荧光,则点击Don't Acquire键。“Intercalating Dyes”程序默认在“Green”通道采集荧光,可以不进行修改。
通过<+>,<—> 按钮可以增加或减少Cycling中的步骤。
![]()
![]()
完成以上设置以后,按键结束“Edit Profile”编辑。回到上一级窗口。
4.2 选择,允许对每个通道的Gain值进行调整。
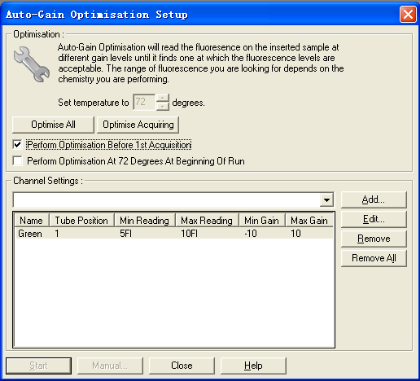
功能允许设置每一通道的灵敏度。设定反应需要采集荧光的温度,选择在哪一步运行校正程序,然后选择需要校正的通道,按键,仪器自动进行校正,完成后按结束对话。
5. 按键进入下一步骤,确认了反应设置后,按开始反应。
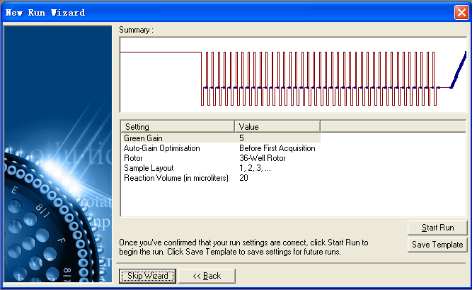
6. 此时会弹出文件保存窗口,该文件包括一次运行的所有信息。
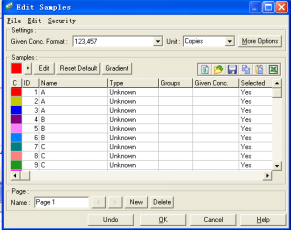
7. 选定保存后,自动弹出样品编辑窗口。该操作窗口用于定义放入转轮内的样品。转轮上的数字对应于操作窗口中的样品号。有以下几种样品类型:
None:该位置无样品。
NTC:阴性对照。
Sample:待测样品。
Standard:标准样品(已知浓度)。
Unknown: 代测样品
Positive Control:阳性对照
Negative Control:阴性对照
完全的样品描述可以存储成样品文件,便于以后类似文件的设置。
每一样品可以选用不同的颜色代表。样品的浓度单位和计数方法也可以该窗口内设置。
该窗口的设置可以在整个反应过程中,以及反应完成后进行调整更改。通过依次点击〈View〉〈sample〉进入该窗口,或是通过右击窗口右边的样品栏可以进入。
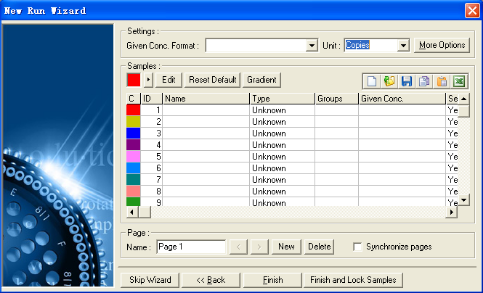
8. 程序运行后,可以在软件界面上实时观察到如下的窗口:
分别显示原始的荧光信号收集界面,温度界面和反应进程界面,窗口右边是样品信息栏。通过此界面可以实时检测PCR反应,知道反应剩余时间,以及升降温情况。
样品信息栏中:
显示目前列表中所有样品
不显示目前列表中所有样品
显示所有命名的样品
显示所有36或72个样品
不显示所有36或72个样品
图表窗口中:
允许手动调整最大最小值
自动调整图表数值范围
回复到默认值(0-100单位)
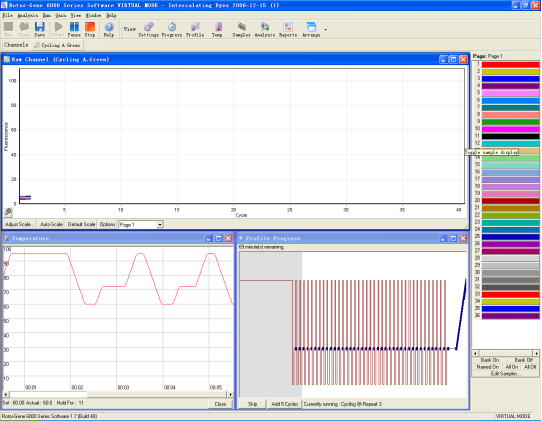
9. 反应完成后或反应进行中,都可通过“Analysis”建,对结果进行分析。选择所需要的分析方法,如:定量分析,熔解曲线分析等之后,按键,则可以在窗口中看到相关图表结果。“Other…”里有更多其他分析方法。
10. 对结果进行分析以后,选择“Report”菜单,可以得到分析结果的报告。通过,, 等按钮可以打印,保存和把报告发到电子邮箱中,也可以把报告以Word的形式输出,此时只需要选择按钮即可。
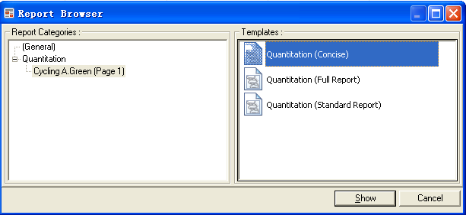
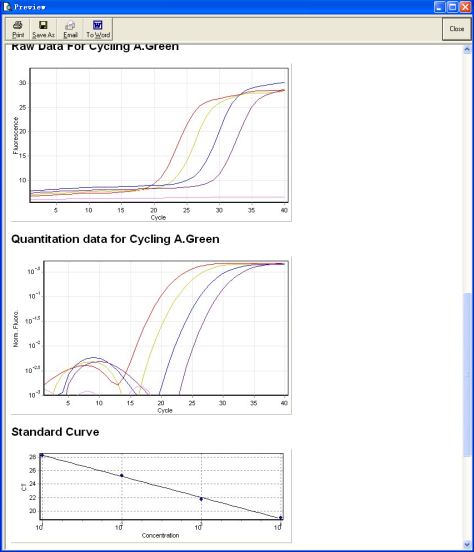
七、 常见问题解答
最初的变性步骤:
u 最初设置的温度和时间是否对Taq酶适合?
检查生产厂家对酶的描述,建议温度是95°C,时间2到15分钟不等,取决于你使用的酶。如果检测的是基因组DNA,最初变性时间最少5分钟,长短取决于DNA的抽提质量。
循环体:
u 在Rotor-Gene上是否要用50ul的反应体积?
Rotor-Gene较适合的反应体积是20-25ul,变性时间是15秒,有些方法要求用50ul的反应体积,则相应的变性时间延长到30秒。
u 变性温度是否合适?
大部分的双链DNA在95°C就开始解链了,在有些情况下在90至94°C都不能很好地变性DNA。由于部分变性,参加反应的探针和引物相应的减少了,因此反应效率会下降。
u 变性时间是否合适?
15到20秒对于变性扩增子是足够了,然而,长一点的产物,可能会需要30秒,60秒的变性时间通常是不需要的。
u 退火温度和时间是否合适?
检查引物和探针的Tm值,Sybr-Green I的退火时间大约20到35秒,双标记探针通常是两步法,退火和延伸合并为一步,时间大约是45到60秒,温度通常在60°C,对于FRET探针退火步骤大约20到30秒。
u 延伸的温度和时间是否合适?
核对Taq厂家的建议,小于300bp的产物建议15到30秒 。
u 在哪一步骤采集信号?
Sybr-Green I应当在72°C,此时绝大部分的DNA是双链状态,如上所述,双标记探针通常是两步检测,因此信号采集应该在退火延伸的整合步骤。对于FRET检测,数据应该在退火步骤检测。如果对于信号采集点不确定,可以多点采集作对比。如果监控屏幕检测不到信号,检查程序设定是否存在至少一个的信号采集点。
熔解曲线分析:
u 在溶解曲线前是否插入一个同溶解程序初始温度相同的一个保温过程?
如果在熔解曲线前没有一个保温过程,则曲线会在前几个循环非常陡峭,使真正的熔解峰型几乎看不到。
u 对于Sybr-Green I熔解曲线分析,可以99°C运行吗?
一些扩增子解链温度高于90°C,期待的熔解峰形可能会看不到,是由于DNA根本就没有熔链。
增益设置:
u 是否选定了合适的增益值?
一些情况下会看到曲线超过了窗口范围,在荧光强度100的地方成一直线。尽管大部分的数据可以用,但是减少增益,一些原始数据就不会超出范围。有时,在第一个循环信号就跳出了窗口范围,这是由于增益选得太高,看起来像没有检测到数据。如果熔解曲线分析时,开始荧光就达到了100,则应当用低的增益重新运行,而不需要重新运行扩增反应,Sybr-Green I 和FRET的样品可以在一定程度上反复使用。
u 是否选用合适的定量设置?
一些情况下观察到完全的原始数据的扩增,但是在定量窗口却看不到数据报告。将定量设置设定到0就能看到所有的数据报告,该设置可以用于排除一些由于探针降解及其它一些探针相关的效应造成的小的荧光变化的样品,这些变化不是由真实的扩增造成的但能观察到稳定的曲线上升。
如果定量曲线能够被最小的定量设置排除,那么下一次反应的增益值应当增加,注意增益值对实际的结果没有影响,期待的倍数增长是相同的。
通常的设置条件:
u 检查是否选择了合适的参数?
进入文件菜单,点击相应的条目,如果对某个条目有什么疑问,或是进入不了相应的设置,同供应商联系。
u 是否选择了合适的转子?
运行前确认该次实验用的是36还是72 孔的转子,选择错的转子会导致每间隔一个样品
的漏检或是一个样品检测两次。
u 仪器使用的是哪一个版本的软件?
软件一直在发展,而且可以从www.corbettlifescience.com网站上免费下载。
实验设置:
如果检查不到样品,检查通道设置,确认数据通过合适的激发和检测获取,这一点对用户定义的通道设置尤其重要。
取决于Rotor-Gene工作的环境,出现的电流波动会导致噪音。Rotor-Gene的软件有这种电流扰动平抑功能,可以检测和记录反应中受到的电流干扰,如果通常或中等的平抑功能不能奏效,则应用强抑制功能选项(4.4或以前的版本)。最近的软件版本,只有一个平抑选项供选择,要么选要么不选,这一种选择(默认的高级抑制选项)建议选上,从实验向导中设定选取。
u 如果以上该注意的都注意了,还是得不到预期的结果,或根本就不工作,该怎么办?
在我们网站主页的用户进入区域,有一个文件“实时定量PCR总结”里介绍了如何优化Sybr-Green I,双标记探针的方法,通常Sybr-Green I预计有5到50倍的信号扩增,双标记探针有2到10倍。
八、Rotor-Gene系统设置注意事项
1) 不要关掉硬盘,确保永不关掉硬盘。
2) 系统不能处于待命状态,确保永不进入待命状态。
3) 不能使用中断3安装任何外围设备
4) 如果网卡使用的是中断3则不能将计算机联入网络
5) 不能使用主板中的中断3
6) 不能安装屏幕保护
7) 转头旋转时要装满管子,不管是72孔还是36孔的转头。如果样品管数不够,将空管填满转头,这将保证在旋转时每管受热的均一性,保证实验结果准确性
8) 保证PCR管壁的干燥,最好使用平头PCR管,并在实验过程中使用管盖压环
9) 保证仪器舱盖处于关闭状态
九、相对定量方法简介Rotor-Gene 6000上的实际操作
1. Comparative Delta-delta Ct法定量流程简介(RG6000软件设置)
1). 先对样品中的目的基因与看家基因分别做标准曲线,通过标准曲线确定两个基因的扩增效率是否一致或接近;将扩增效率优化为一致
2). ![]()
![]()
![]() 同一样品分别进行看家基因和目的基因的扩增,分列在两页中
同一样品分别进行看家基因和目的基因的扩增,分列在两页中
Comparative Delta-delta Ct法的特点、注意事项及实际应用
1). Comparative Delta-delta Ct法是很常用的一种相对定量方法,其最大特点是,当优化的体系已经建立后,在每次实验中无需再对看家基因和目的基因做标准曲线,而只需对待测样品分别进行PCR扩增即可。
2). 其缺点是,每次实验都默认目的基因和看家基因的扩增效率一致,而并非真实扩增情况的反映,这里势必存在一定的误差。
3). Comparative Delta-delta Ct法展开定量实验前,在预实验中,必需对目的基因和看家基因做两组标准曲线。Rotor-Gene 的软件会自动给出两组标准曲线的R值、扩增效率等信息,如果两组标准曲线的斜率,即M值的差小于0.1,那么后续实验中就可以用Comparative Delta-delta Ct法进行相对定量分析。反之,如果M差值大于0.1,就无法用该方法进行相对定量分析。此时的解决方法有两种,一是优化实验,使两组标准曲线的斜率差值小于0.1,二是换用其它的相对定量方法。
应用实例:
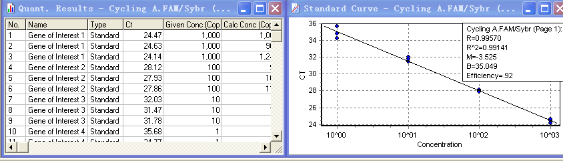
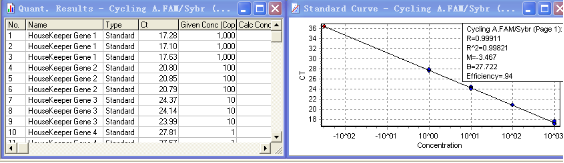
如上图,将标准品进行梯度稀释后,分别对目的基因(Gene of Interest)和看家基因(Housekeeper Gene)做标准曲线。软件自动绘制标准曲线,并给出相应的参数。从上图可知,两组标准曲线的M值分别为-3.525和-3.467,两者的差值<0.1,因此,这组看家基因和目的基因可以用Comparative Delta-delta Ct法两进行相对定量。
在完成上述预实验之后,接下来就可以正式对待测样品进行定量分析。
在该实验中,分别对待测样品的看家基因和目的基因进行扩增,下图即为一个标准的扩增分析结果:
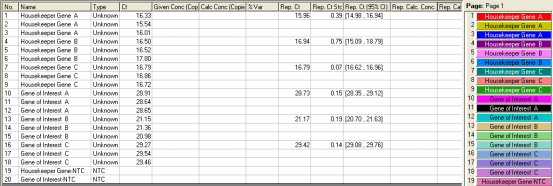
为进行Comparative Delta-delta Ct分析,需要对样品进行一些编辑。简而言之,即将目的基因和看家基因分别编辑在两页中(page),并将同一样品命名成相同名称。
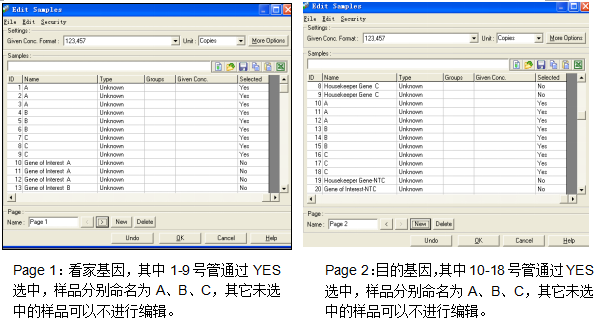
在该实验中,分别对三个样品A、B、C进行了分析,其中1-9号管检测了看家基因,10-18号管检测了目的基因。
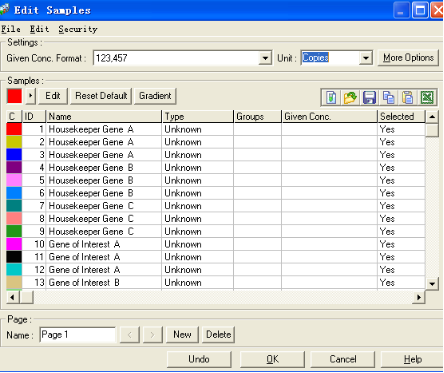
可通过NEW新建一个page,并通过Selected选择每页中分析的对像。将两组基因分别编辑在两页中,并将相同的样品命名成同一名称后,即为下图所示:
样品编辑好后就可进行分析工作。通过进入Analysis,分别对page1和page2进行分析。注意:由于没有标准品,软件无法自动给出阈值,需用手动设定,软件会提示需手动进行阈值设定,此时只要点中右侧按扭,在荧光曲线图中上下拖动光标即可。
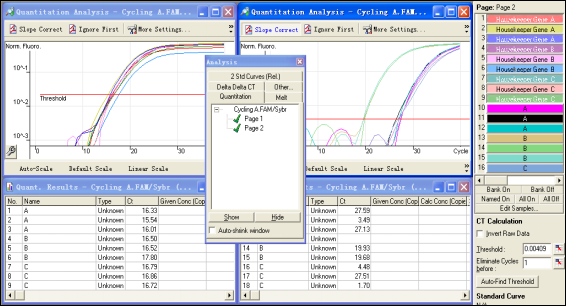
完成两页分析之后,再进入Delta Delta CT分析界面,选择show,此时,软件的向导界面会提示使用者一步步完成设置:
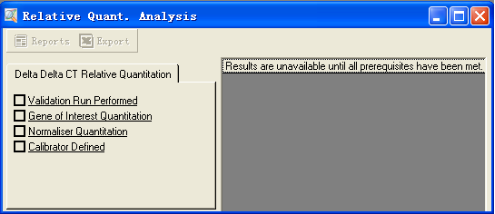
由上至下,依次完成各项设置。
第一项:Validation Run Performed,提示是否已验证过两个基因的扩增效率一致,可用该定量方法进行分析。选择Yes;
第二项:Gene of Interest Quantitation,选中Page 1或Page 2中编辑了目的基因的那一页;
第三项:Normaliser Quantitation,选中Page 1或Page 2中编辑了看家基因的那一页;
第四项:Calibrator Defined,选中A、B、C三个样品中用来作为对照组的一个。
完成上述四项设置之后,在窗口右侧就显示相对定量结果,如图所示:
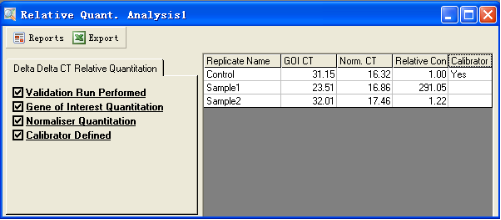
结果给出三个样品目的基因和看家基因的平均CT值,以及样品B、C中目的基因的浓度相对于对照组A的比值。
2. 双标准曲线法定量流程(RG6000软件设置)
1). 用双标准曲线法定量时,每次每个基因都需要做目的基因和看家基因的标准曲线,必需有一组稳定的标准品。
2). 同一样品做标准曲线,分别对目的基因和看家基因做标准曲线,分列在两页上。
![]()
![]()
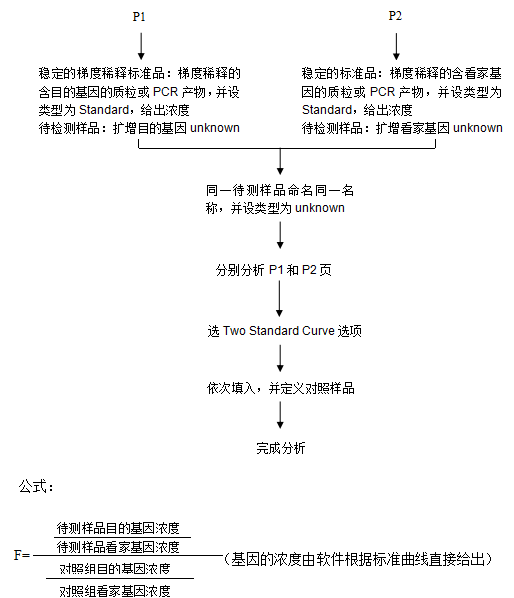
(基因的浓度由软件根据标准曲线直接给出)
![]()
双标准曲线法的特点、注意事项及实际应用
1. 双标准曲线法做相对定量分析的最大特点是,应用简便,无需像Delta-delta CT法那样对实验进行严格的优化。
2. 其不足之处是每次实验都必需对目的基因和看家基因做两组标准曲线。
3. 并且,如果用于做标准曲线的标准品不同于样品,比如标准品为质粒或纯化的PCR产物,而待测样品为cDNA,那么标准曲线的扩增效率并不能真实地反映样品的扩增情况,因此以标准曲线来计算样品的实际浓度就存在一定误差。
应用实例:
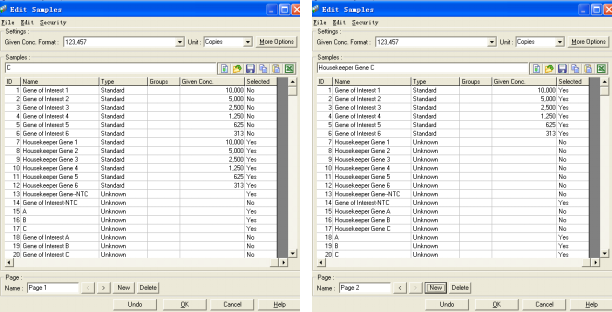
在该实验中,样品管1-6为目的基因的标准曲线,7-12为看家基因的标准曲线,待测样品A、B、C,其中15-17扩增了样品的看家基因,18-20扩增了样品的目的基因。
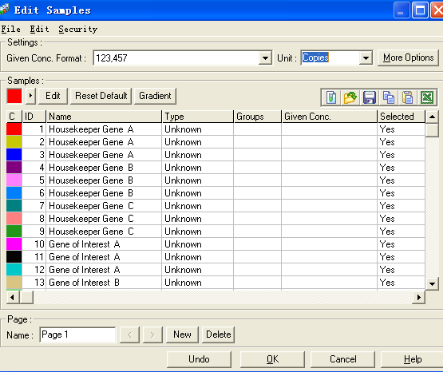
在用双标准曲线法做相对定量之前,同样需要对样品进行一些编辑。方法与Delta-delta CT法类似,即将所有目的基因编辑在一个page里,所有看家基因编辑在另一个page里,且相同的样品以同样名称命名。编辑完成之后即得:
样品编辑好后就可进行分析工作。进入Analysis,分别对page1和page2进行分析。
完成分析之后,从Other进入,选择2 Standard Curves Relative Quantitation。根据提示向导依次完成设置。
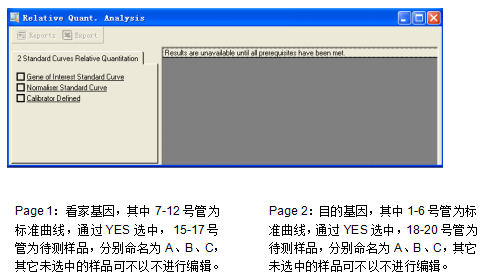
依次选中目的基因的page、看家基因的page以及对照组(例,以A为对照组),如图:
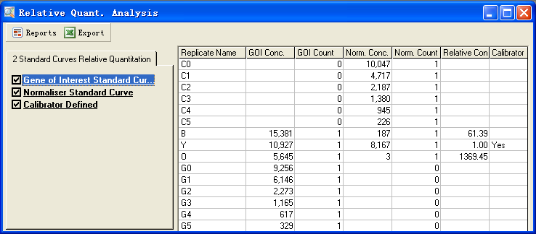
结果包括计算所得的各标准品及待测样品的浓度及CT值,以及样品B、C的目的基因相对于对照组A的浓度。
3. Comparative Quantitation法定量流程(RG6000软件设置)
1). 该方法并不常用,因为必需确定起始样品的总核酸浓度一致。在芯片验证时使用较多,但同样也必需有起始浓度一致的核酸样品。
2). 作为常规的基因表达调控研究,建议研究者使用前两种定量方法。
3). 该方法通过拐点时的循环数来进行相对定量比较,重复性更好。
4). 该方法操作非常简便,无需做标准曲线及设置内参。使用时,样品均定义为unknown,分析时选用Comparative Quantitation,确定对照组,完成分析。
应用实例:
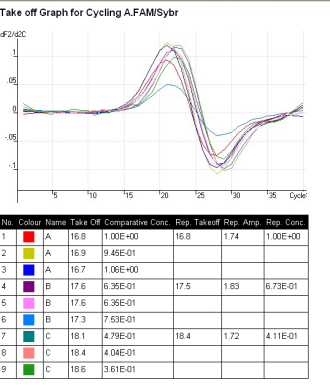
用Comparative Quantitation法进行定量分析时,在保证起始总核酸量一致的前提下,只要对目的基因进行扩增即可,例:待测样品A、B、C,扩增目的基因。
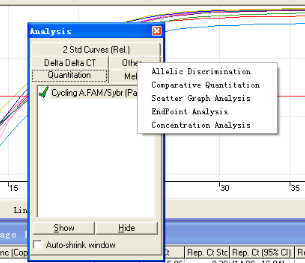
进入Analysis,在Other中选择Comparative Quantitation。
选中后点击Show即给出分析结果。
![]()
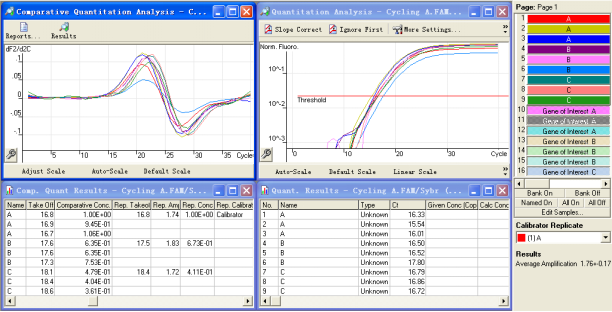
上图左下方即相对表达量的结果,其中Rep.Conc为样品B、C相对于对照组A的目的基因浓度。右侧,可通过修改Calibrator Replicate改变对照组,以获得不同的比较结果。
在Report中同样给出拐点图和相对定量的比值结果: